서해상 PM2.5 내 탄소성분 및 유기성분의 화학적 특성
Abstract
Characteristics of carbonaceous components and organic compounds in PM2.5 over the atmosphere of the Yellow Sea were investigated. PM2.5 samples were collected onboard the meteorological research vessel, GISANG 1, over the Yellow Sea during the YES-AQ campaign in 2018 and 2019, respectively. The average concentrations of carbonaceous components in this region were 2.59 ± 1.59 μg m-3 for the OC, 0.24 ± 0.10 μg m-3 for the EC, 2.14 ± 1.30 μg m-3 for the WSOC and 1.17 ± 0.94 μg m-3 for the HULIS-C, respectively. The total concentration of 56 organic compounds (∑OCs) accounts for 10% of OC. The main group among organic compounds were dicarboxylic acids which account for 57% of ∑OCs, followed by n-alkanoic acids accounting for 34% of ∑OCs. In n-alkanoic acid distribution, hexanoic (C6:0) and octanoic (C8:0) acids which are low molecular weight n-alkanoic acids and known as emitted from marine biogenic activities were dominant in this region. Furthermore, non-HULIS-C fraction increased when the air mass originated from the marine region rather than the continental region. When the Asian dust episode was observed, the WISOC concentrations along with the levoglucosan were increased, while the haze episodes caused the increase of WSOC, HULIC-S and DCAs. In this study, we found that the components of carbonaceous and organic aerosols in PM2.5 over the Yellow Sea were changed with the specific air pollution episodes. It indicates that the physicochemical properties of PM2.5 can be changed by the air pollution episodes in this region.
Keywords:
Carbonaceous components, organic compounds, the Yellow Sea, WSOC, HULIS-C1. 서 론
초미세먼지(particulate matter with an aerodynamic diameter less than or equal to 2.5 μm, PM2.5)는 일반적으로 공기 역학적 직경이 2.5 μm 이하의 대기를 부유하는 입자상 물질이며, 황산과 질산, 암모늄 등으로 구성된 무기염들과 함께 탄소성분으로 이루어진 원소탄소(Elementary Carbon, EC)와 유기성분[유기성분들의 탄소는 유기탄소(Organic Carbon, OC)라고 칭함]으로 구성되어 있다. PM2.5를 구성하는 유기성분들 중에는 유해성이 높은 성분으로 알려진 다환방향족 탄화수소(Polycyclic Aromatic Hydrocarbons, PAHs) 등을 함유하고 있고, 기후변화영향 측면에서도 PM2.5의 흡습성 및 광학적 특성을 변화시키거나 구름응결핵으로 작용할 수 있다(Xiao and Liu, 2004; Shilling et al., 2007; IPCC, 2013).
OC는 배출원에서 대기 중으로 직접 배출된 일차유기탄소(Primary Organic Carbon, POC)와 대기중에서 광화학 반응으로 통해 이차적으로 생성된 이차유기탄소(Secondary Organic Carbon, SOC)가 있다. 반면, EC는 주로 화석연료 연소에 의해 직접 배출된다(Han et al., 2008). 수용성 여부에 따라 OC는 수용성 유기탄소(Water-Soluble Organic Carbon, WSOC)와 불용성 유기탄소(Water-InSoluble Organic Carbon, WISOC)로 구분된다. WSOC의 주요 생성원은 대기 중 휘발성 유기화합물(Volatile Organic Compounds, VOCs)의 산화를 통해 생성된 유기성분들이 입자상 응결 또는 응핵 과정을 통한 2차 생성에 의한 것으로 알려져 있다(Yu et al., 2004). 대기환경분야에서는 WSOC에서 humic(휴믹) 특성과 유사한 화학적 성질을 보이는 성분들을 HUmic-LIke Substance (HULIS)라 칭하여 분리하였고, HULIS 내 탄소(HULIS-C)는 에어로졸의 광학특성을 변화시킬 수 있는 브라운 카본의 한 종류로 분류되고 있다(Jung et al., 2018). 현재 HULIS는 분자 수준의 화학 분석이 완성되지 않았지만, 지역 및 발생원에 따라 구조가 다르고, 다수의 벤젠고리와 하이드록시기, 그 외 다양한 반응기를 함유하고 있는 것으로 보고되고 있다(Paglione et al., 2014). HULIS의 생성원인으로는 바이오매스의 연소(Mayol‐Bracero et al., 2002; Samburova et al., 2005; Lukács et al., 2007)와 VOCs의 2차 반응(Hoffer et al., 2004)이 있다.
PM2.5를 구성하는 성분들 중 약 1,000여 종이 넘는 유기성분들은 PM2.5 전체 질량의 20~50%를 차지하는 것으로 보고되고 있다(Kanakidou et al., 2005; Putaud et al., 2010). 이러한 유기성분은 발생원이나 지역, 계절에 따라 다양한 농도 및 구성 특성을 보이기 때문에, 유기성분의 분포특성을 바탕으로 대기 중 PM2.5의 발생원 특성을 파악하는데 활용되고 있다(Schauer et al., 1996).
서해상 지역은 우리나라와 중국에서 발생한 영향을 복합적으로 받으며, 서해상의 에어로졸을 통해 편서풍 풍하 측에 위치한 한반도, 일본, 그리고 태평양으로 유입되는 장거리 오염물질을 직접적으로 모니터링 할 수 있다(Lee et al., 2001). 국내에서 진행된 PM2.5의 장거리 이동 특성을 파악하기 위한 대부분의 관측은 풍하 지역의 자체 발생원의 영향을 받는 지상관측이 주를 이루었기 때문에, 이는 실제 장거리 이동의 특성을 파악하기에 제한적이다. 이를 해결하기 위하여 국립기상과학원에서는 국립환경과학원, 연세대학교, 고려대학교 및 이화여자대학교 등의 연구기관과 협력하여 서해상 대기질의 물리·화학적 특성을 파악하기 위한 서해상 대기질 입체관측 캠페인(YEllow Sea-Air Quality, YES-AQ)을 2018년과 2019년 4~6월 동안 수행하였고, 기상항공기와 선박 및 지상 관측이 동시 수행되었다. 이를 통해 국내에서 선박으로 측정한 해상 에어로졸의 구름응결핵 수농도 및 에어로졸의 질량농도와 화학 조성 특성에 관한 연구가 수행되었으며, 해양성 황순환 물질인 methanesulfonate가 국내의 남해보다 서해상에서 약 3배 높고, 에어로졸 수농도의 결과는 서해상에서 동아시아 몬순 기후의 영향을 받으며, 구름응결핵의 특성은 aged된 육지 에어로졸의 특성과 유사한 것으로 보고되었다(Cha et al., 2016; Park et al., 2021).
본 연구에서는 YES-AQ 일환으로, 국내 최초로 서해상의 대기 중 PM2.5 내 탄소 및 유기성분들의 화학 조성 특성을 이해하고자 하였다. 이를 위해 YES-AQ기간 동안 선박에서 고용량공기채취기를 이용하여 PM2.5를 채취하였다. 그리고 PM2.5를 구성하는 탄소성분(OC, EC, WSOC, HULIS-C)과 5개 그룹으로 구분할 수 있는 56종의 유기성분들[PAHs, n-Alkanes, n-Alkanoic acids, Sugars, DiCarboxylic Acids (DCAs)]을 분석하여 서해상에서 이들의 농도 분포 특성을 이해하고자 하였다. 또한, 대기현상별 서해상에서 발생한 고농도 사례의 특성을 파악하고자 하였다. 본 연구의 결과는 향후 지상관측과 비교하여 국내로 유입되는 에어로졸의 특성을 이해하는 자료로 활용될 수 있으며, 기후 및 대기 모델을 위한 기초입력자료로 활용될 수 있을 것으로 기대한다.
2. 연구 방법
2.1 PM2.5 시료 채취
본 연구에서는 해양기상 관측선인 기상 1호를 이용하여 서해상 동경 124° 부근의 북위 35°~37°를 왕복하며 PM2.5를 채취하였다(Fig. 1). 시료의 채취는 2018년에 4항차의 운행기간(1차: 4월 17~27일, 2차: 5월 3~11일, 3차: 5월 15~25일, 4차: 5월 31일~6월 8일)과 2019년에 4항차의 운행기간(1차: 4월 16~23일, 2차: 5월 1~9일, 3차: 5월 16~23일, 4차: 6월 5~12일)동안 시행 하였다. 각 시료들은 하루 약 9시간(8시부터 17시까지)동안 채취하였고, 2018년에는 총 17회, 2019년에는 총 23회의 시료들을 채취하였다. PM2.5 시료는 대기오염공정시험기준(ES 01604.1)에 따라 고용량 공기채취기(PM2.5 high volume air sampler, HV-RW, SIBATA, Japan)에 PM2.5용 임팩터를 이용하여 1000 L min-1의 유량으로 포집하였다. 임팩터는 좁은 슬릿을 통해 입자를 가속시켜 충돌판에 충돌시키면 특정 크기 이하의 입자만을 포집할 수 있는 방식이다. 이 때, PM2.5를 채취한 여과지는 탄소 및 유기성분 분석을 위하여 석영섬유 여과지[Quartz microfiber filter (QMF), 203 mm × 254 mm, 2500QAT-UP, PALL science, USA]를 사용하였다. QMF는 시료 채취 전 여과지에 잔존하는 유기물을 제거하기 위하여 450°C에서 24시간 가열 후 사용하였으며, 채취 후에는 분석 전까지 -20°C에 냉동 보관하였다.
2.2 화학적 성분분석
PM2.5 내 OC와 EC 분석은 Sunset의 OCEC 분석기(Model 5L, serial #375, Sunset laboratory Inc., USA)를 이용하여 분석하였고, NIOSH (National Institute of Occupational Safety and Health) 5040의 열광학 투과도(Thermal-optical transmittance, TOT) 분석 방법을 적용하였다(Birch and Cary, 1996). PM2.5 시료를 1.5 cm2 크기로 절단하여 분석하였다. OC는 오븐 내 He 상태에서 310°C~870°C의 온도 단계에 따라 측정되고, EC는 산화제인 O2가 주입된 상태에서 550°C~870°C의 온도 단계에 의해 측정한다. 이 때, 측정한 시료의 레이저 투과도 결과로 EC 중 열분해된 OC(Pyrolyzed OC, PC)를 보정한다. PC는 시료에서 OC상태로 존재했으나 OCEC 분석기 내부의 온도가 증가함에 따라 열분해 되고, EC와 같이 시료의 투과도를 낮추는 특징을 보인 탄소이다. 오븐 내 온도가 증가하여 PC가 발생하면 레이저 투과도가 감소하고, O2가 주입되어 PC가 산화되면 여과지에서 기화하여 시료의 레이저 투과도가 다시 증가한다. 따라서, O2가 주입된 후의 레이저 투과도가 분석 시작 시의 레이저 초기값과 동일 해지는 지점을 기준으로 분석된 탄소를 OC와 EC로 보정한다. 본 연구에서는 시료 분석 전 Sucrose 표준용액을 주입하여 기기의 내부표준물질(ch4)의 정확도를 확인하였고, 오차범위 ± 5% 내였다. 또한, OC 및 EC분석법의 정확도 검증을 위해 Sunset사의 OC와 EC 평가 시료(Performance Evaluation Sample, PES-5-C-B-NIO)를 분석하였고, Sunset사에서 동일한 시료를 분석한 결과에 비해 본 연구에서 분석한 결과는 OC가 96 ± 4.0%, EC가 80 ± 2.0%로 평가 되었다.
PM2.5 내 WSOC와 HULIS-C을 분석하기 위하여 PM2.5 시료(203 mm × 254 mm)의 3 cm×5 cm을 잘라서 초순수(18 MΩ) 40 mL로 1시간 동안 초음파 추출하였다. 주사기 필터(0.2 μm PTFE membrane, Hydrophilic, ADVANTEC, Tokyo, Japan)를 이용하여 필터의 이물질과 불용성 미립자를 제거한 후, 40 mL의 추출물 중 20 mL를 Sievers M9 Laboratory Total Organic Carbon (TOC) Analyzer (General Electric Power and Water Analytical Instruments, Boulder, CO, USA)를 이용하여 WSOC를 분석하였고, 나머지 20 mL는 HULIS-C 분석용으로 사용하였다. 사용된 TOC 기기는 자외선 복사와 과황산 암모늄을 사용하여 유기화합물을 산화시키고, 생성된 CO2를 측정하는 방법으로 총탄소양에서 무기탄소를 제외한 탄소농도를 TOC의 농도로 계산한다(Godec et al., 1991). HULIS-C의 분석방법은 Lin et al. (2010)에 제시된 방법을 따랐다. 시료 용출액 20 mL를 HCl용액을 이용하여 pH 2로 산성화시키고, 이 중 15 mL 내에 존재하는 HULIS를 분리한 후 최종적으로 HULIS-C를 TOC 기기로 분석하였다. 본 연구에서 HULIS의 분리는 SPE (Solid Phase Extraction) 법을 적용하였고, 이 때 사용한 카트리지는 Oasis사의 HLB (30 μm, 60 mg/cartridge, Waters, USA)를 이용하였다. HLB 카트리지는 Hydrophilic-Lipophilic-Balanced의 특성을 가지고 있으며, 수용성 성분의 N-vinylpyrrolidone과 친유성의 divinylbenzene을 함유하고 있다. 따라서, 저분자량의 친수성이 강한 성분들은 카트리지를 통과하고, 고분자량의 사슬형 탄화수소와 방향족 탄화수소에 하이드록실, 카보닐, 카르복실 등의 작용기가 있는 물질들은 카트리지에 흡착하게 된다. 따라서, 고분자이면서 극성이지만 약간의 소수성을 가진 물질들을 HULIS라 할 수 있다.
유기성분은 PAHs (13종), n-alkanes (17종), n-alkanoic acids (12종), sugars (2종), DCAs (12종)을 분석하여, 총 56개의 개별 유기성분을 분석하였다. 개별 성분들에 대한 자세한 정보는 Table 1에 제시하였다. 우선, PM2.5 시료를 디클로로메탄과 메탄(3:1, v/v) 용매에 넣은 후 30분 동안 초음파 추출을 통해 유기성분을 추출하였고, 이 과정을 2회 반복하였다. 유기성분들의 정량화 과정에서 내부표준법을 적용하기 위하여 시료에 11종의 표준물질(Phenanthrene-d10, Chrysene-d12, Perylene-d12, Benzo[ghi]perylene-d12, Pyrene-d10, Fluoranthene-d10, Tetracosane-d50, Triacontane-d62, Succinic acid-d6, Levoglucosan-c13, Myristic acid-d27)의 내부표준물질을 주입하였다. 추출액은 질소농축기(Zymark Turbo Vap 500)를 이용하여 40°C에서 100 mL까지 1차 농축한 후, Teflon filter (ID 25 mm; pore size 0.45 μm)로 정제하였다. 정제한 용출액을 다시 최종 부피인 0.5 ± 0.1 mL로 2차 질소 농축하여 GC/MS(Gas Chromatography/Mass Spectrometry, Agilent 7890A GC/Agilent 5975 MS)로 분석하였다. GC 컬럼은 DB-5MS (30 m long × 0.25 mm ID × 0.1 μm film thickness, diphenyl-dimethyl polysilozane phase capillary column)을 사용하였고, 시료 1 μl를 splitless 모드의 GC에 주입하였다. GC 주입구 온도는 280°C, MS의 ion source 온도는 230°C로 분석하였다. 극성 유기성분은 최종 농축액의 500 μl를 취하여 히팅 블록(REACTI-THERM #18822 Heating module, Thermo Scientific)에서 75°C, 1.5시간 동안 1%의 TMSC (50 μl)와 pyridine (50 μl)의 N,O – Bis (trimethylsilyl) trifluoroacetamide (BSTFA)로 유도체화한 후 GC/MS로 분석하였다. 분석과정의 회수율(Recovery)과 검출한계(Method detection Limit, MDL)에 대한 실험결과는 Table 1에 정리하였다. 또한, 바탕시료(Blank)를 분석한 결과 값이 MDL보다 낮은 농도이거나 전체 시료 값의 5% 이내인 것을 확인 하였고(Table 1), 농도 자료에 Blank를 보정하지 않았다.
2.3 역궤적 분석 및 군집분석
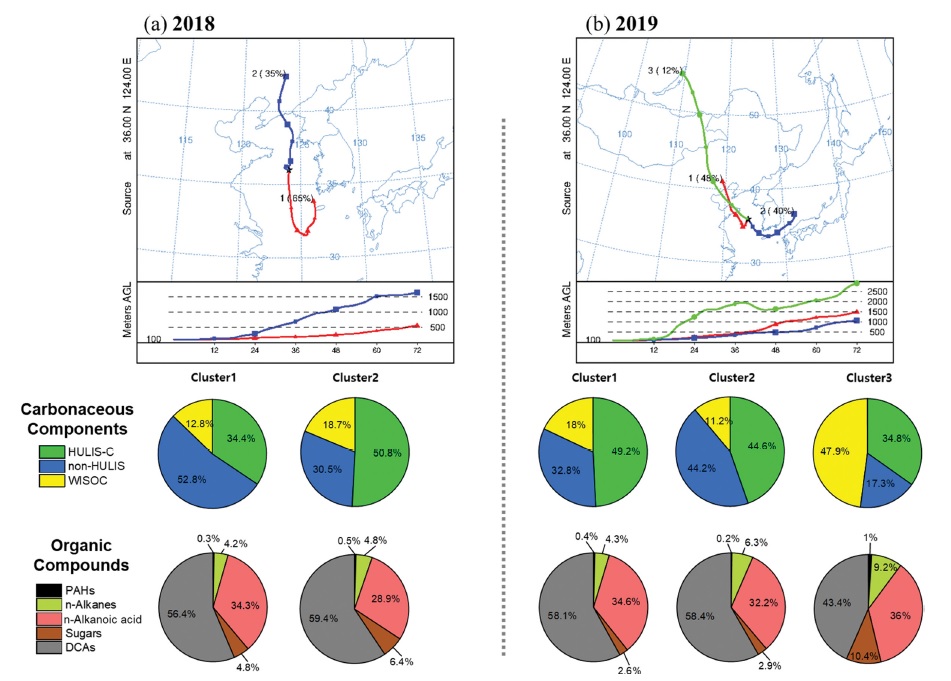
PM2.5시료를 채취한 날들에 대한 기류의 이동경로를 파악하기 위하여 NOAA (National Oceanic and Atmospheric Administration)의 HYSPLIT4 (Hybrid Single Particle Lagrangian Trajectory) 역궤적 모델을 활용하였다. 역궤적 계산에 필요한 기상자료는 수평해상도가 1°인 GDAS1 (Global Data Assimilation System)를 사용하였고, 서해상 왕복 항로의 중앙지점인 동경 124°, 북위 36°을 수용점으로 지정하여 기상 1호에 설치한 고용량공기채취기의 고도인 100 m 상공의 공기를 72시간 동안 분석하였다. 서해로 유입된 공기괴의 통계적 이동분포를 분석하기 위해 유입 공기괴 흐름의 유사성을 기반으로 동질 집단으로 묶는 군집분석을 시행하였다. 군집의 개수는 군집들 내 TSV(Total Spatial Variance)를 토대로 결정하여 2018년 17개의 시료들은 2개의 군집, 2019년의 23개의 시료들은 3개의 군집으로 분류하였다.
3. 결과 및 고찰
3.1 서해상 PM2.5 내 탄소성분 농도 및 조성 특성
2018년과 2019년에 진행된 YES-AQ 기간 중의 서해상 탄소 성분별 평균 농도를 Fig. 2에 나타냈고, 2018년 측정한 OC, EC, WSOC와 HULIS-C의 평균 농도는 2.57 ± 1.54 μg m-3, 0.25 ± 0.10 μg m-3, 2.18 ± 1.35 μg m-3, 1.11 ± 0.96 μg m-3였다(Table 2). 2019년의 각 탄소성분별 농도의 평균은 2.61 ± 1.66 μg m-3 (OC), 0.23 ± 0.10 μg m-3 (EC), 2.11 ± 1.30 μg m-3 (WSOC), 1.22 ± 0.94 μg m-3 (HUIS-C)로 나타났다(Table 2). 각 탄소성분들의 평균 농도가 연도 간에 유의적 차이가 있는지 검증하기 위해 SPSS를 이용하여 Mann-Whitney U Test를 실시한 결과, OC와 EC, WSOC, HULIS-C는 신뢰수준 95%에서 유의미한 차이가 없는 것으로 나타났다. 서해상의 탄소성분 농도는 기존에 연구되었던 인도양과 대서양의 OC 농도 0.22~0.24 μg m-3보다 약 10배 높은 수준이며, OC 내 WSOC는 인도양과 대서양에서 16~32% 차지한 비율보다 본 연구에서 WSOC가 OC 내 차지하는 비율이 더 높은 것을 확인하였다(Claeys et al., 2010; Decesari et al., 2011). 또한, 서해상에서의 탄소성분들의 농도 수준을 파악하기 위하여 2017년 비슷한 계절(4~6월)에 TISCH사의 고용량 공기채취기로 안면도 기후변화감시소(Global Atmosphere Watch station, GAW station)에서 포집하여, 본 연구와 동일한 방법으로 분석한 PM2.5 내 화학성분 농도와 비교하였다(Fig. 2). 안면도에서의 OC평균 농도는 4.39 ± 1.80 μg m-3, EC 농도는 0.49 ± 0.25μg m-3, WSOC 농도는 2.61±1.18μg m-3이었고, HULIS-C 농도는 1.81 ± 0.74 μg m-3이었다. 이러한 서해상의 OC, EC, WSOC, HULIS-C 각각의 결과는 안면도의 농도보다 약 40%, 50%, 20%, 35% 낮은 수준이었다. Figure 2b에서는 안면도와 서해상에서의 각 탄소성분들의 분율을 나타내고 있다. 서해상에서 측정한 결과에서는 OC 내 WSOC의 비율이 약 87%를 차지하는데 비해 안면도에서는 WSOC가 평균 61%로 WSOC 비율이 서해상에서 약 25% 더 높은 것을 확인하였다. 친유성 성격이 강하고, 탄화수소로 구성되어 있을 확률이 높은 WISOC는 EC와 함께 일차배출원의 영향을 지배적으로 받는다고 보고되고 있다(Miyazaki et al., 2006). WISOC의 경우 안면도가 서해상에 비해 약 4배 정도의 비율을 차지하고 있음을 확인하였고, EC도 역시 안면도가 서해상에 비해 약 2배정도 높았다. 대기 중으로 직접 배출되는 화학성분으로 알려진 WISOC와 EC가 안면도에서 농도가 더 높은 것은 안면도 지역이 서해상보다 자동차 등 연소기원의 직접 배출의 영향이 큼을 의미하고, 더 나아가 서해상의 탄소성분들의 성질은 안면도에 비해 친수성이 더 높을 수 있음을 의미한다.
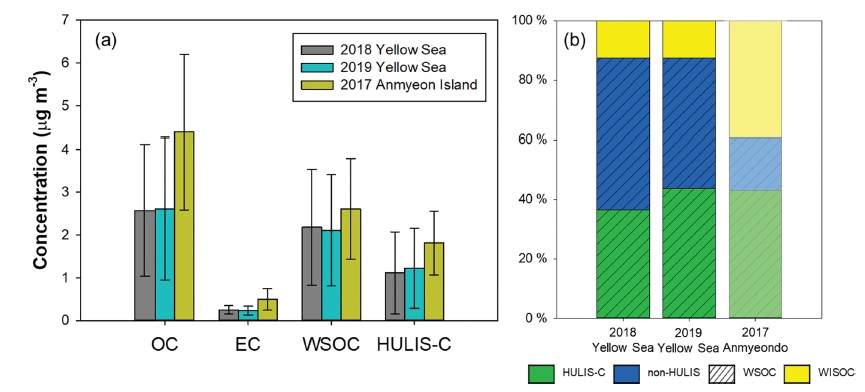
(a) Average concentrations and (b) carbonaceous compositions in OC in PM2.5 of the Yellow Sea and Anmyeondo. PM2.5 of Anmyeon Island represents the air of clean background area of South Korea in April~June, 2017.
3.2 서해상 PM2.5 내 유기성분 농도 및 조성 특성
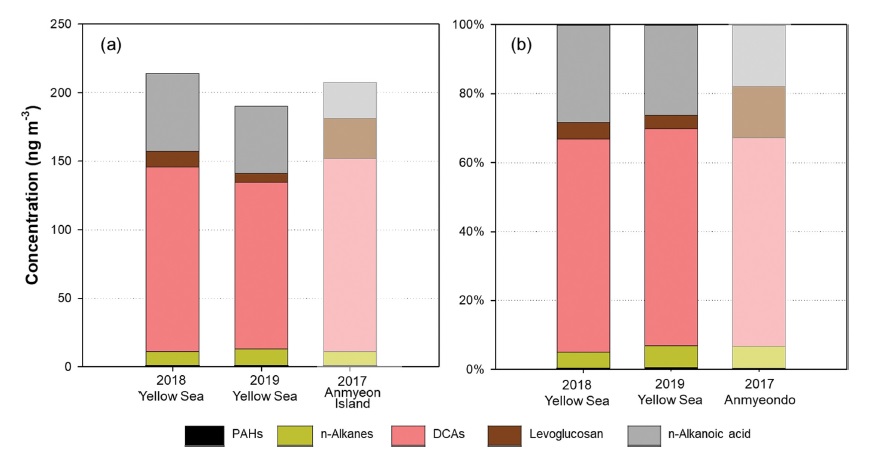
YES-AQ기간 동안 서해상 총 유기성분(∑OCs)의 평균 농도는 2018년에는 230 ± 75.4 ng m-3, 2019년에는 212 ± 102 ng m-3였고, 전체 유기성분의 연간 평균 농도는 Mann-Whitney U Test를 통해 확인한 결과, 95% 신뢰수준에서 유의미한 차이를 보이지 않았다. ∑OCs는 OC 농도의 10.6% (2018년)와 11.0% (2019년)를 차지하였고, OC 농도와 총 유기성분 농도의 상관성계수(r)는 2018년에 0.79, 2019년에 0.70으로 OC와 총 유기성분간의 상관성이 있음을 확인하였다. PAHs와 n-alkanes, n-alkanoic acids, sugars, DCAs에 대한 총 농도의 평균은 Table 2에 나타냈다. 그룹별로 총 농도를 차지하는 분율은 2018년과 2019년 모두 DCAs가 58%와 56%로 가장 큰 비중을 차지하였고, 그 다음으로 n-alkanoic acids가 33%와 34%로 높게 나타났다(Fig. 3).
(a) Average concentrations and (b) composition of analyzed organic compounds in PM2.5 of the Yellow Sea and Anmyeon Island.
DCAs는 인위적인 배출원을 통해 대기 중으로 직접 배출되기도 하지만, 대기중 화학 반응을 통해 생성되는 SOAs의 주요한 지표로 활용되고 있다(Rogge et al., 1993; Kawamura et al., 1996). Figure 4a에 DCAs의 개별 유기성분의 평균 농도를 나타내었다. DCAs 중 Malic acid와 Succinic acid가 각각 24%, 23%로 큰 비중을 차지하였다. Succinic acid는 메탄을 제외한 VOCs (non-methane VOCs, NMVOCs)가 광화학 반응을 통해 전환된 물질 혹은 불포화 지방산이 산화되어 생성된 물질로 알려져 있고(Kawamura et al., 1996), Malic acid는 낮은 고도의 해양 에어로졸에서 주로 나타나며 Succinic acid가 Oxalic acid와 Malonic acid를 생성하는 중간과정의 생성물이다(Hatakeyama et al., 1987; Kawamura and Sakaguchi, 1999). 반면, 안면도의 DCAs에서는 Malonic acid가 31%로 가장 높았으며, Malic acid와 Succinic acid 경우는 서해상과 비슷한 농도 수준을 보였지만 DCAs를 차지하는 전체 비율은 각각 18%, 19%로 낮았다. 또한, Wang et al. (2006)에서 남극해의 DCAs는 평균 4.5 ng m-3, 태평양에서 DCAs 60 ng m-3으로 본 연구의 DCAs 농도 보다 낮았으며, 두 해양 지역에서 DCAs 내 약 50%를 Oxalic acid가 차지하였다.
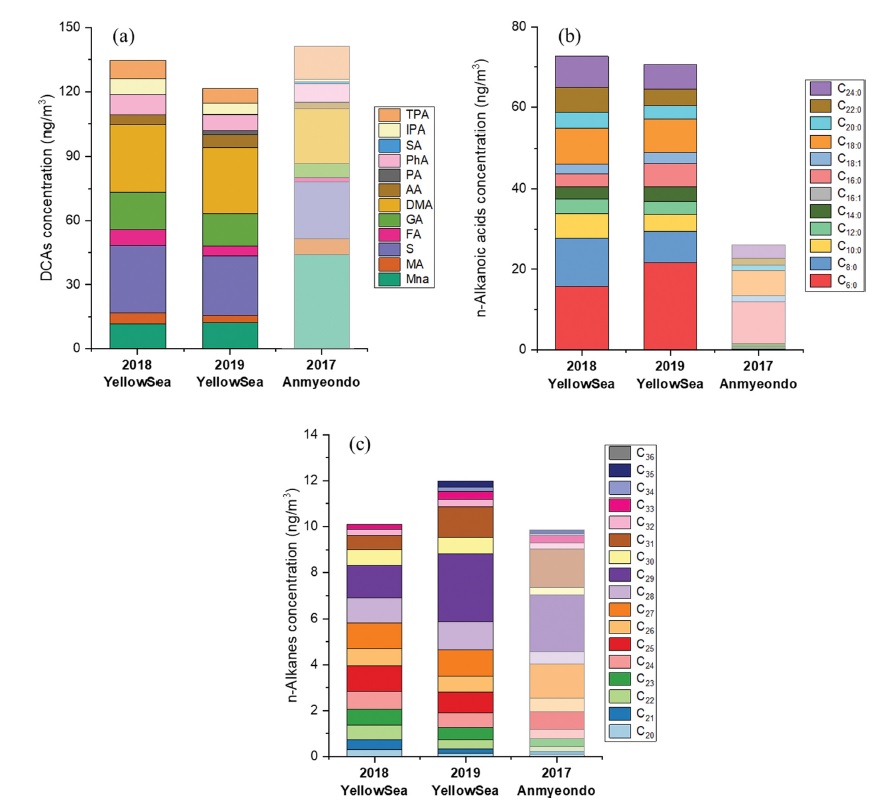
Average concentrations of individual (a) DCAs, (b) n-alkanoic acids and (c) n-alkanes in PM2.5 samples collected over the Yellow Sea during YES-AQ campaigns in 2018 and 2019, and Anmyeondo GAW regional station. C6:0 and C16:1 were not analyzed at Anmyeondo.
n-Alkanoic acids는 식생 및 바이오매스 연소에 의해 대기로 배출되는 것으로 알려져 있으며, 탄소가 20개 이하인 낮은 분자량을 가진 n-alkanoic acids는 해양 식물성 플랑크톤 및 식물에서 기인한다고 보고되었다(Simoneit and Mazurek, 1982; Kawamura et al., 2003). 본 연구에서는 탄소의 개수가 6개와 8개인 n-alkanoic acids가 두드러지는 특징을 나타내었다(Fig. 4b). 반면, 안면도에서는 C16:0 (39%)과 C18:0 (24%)이 n-alkanoic acids에서 가장 높은 분율을 차지하였고, 서해상에서 높게 나타난 C8:0은 매우 낮았다.
n-Alkanes 중 최고 농도를 보이는 성분의 탄소수(Carbon number Maximum, Cmax)는 2018년과 2019년 모두 C29로 동일하였다(Fig. 4c). n-Alkanes 성분들 중 Cmax가 탄소수가 높은 성분일수록 n-alkanes은 식물에 의한 영향이 크다고 보고되고 있다(Mazurek and Simoneit, 1984; Simoneit et al., 1991). 또한, n-alkanes의 탄소 선호지수(Carbon number Preference Index, CPI)를 통해 배출원의 특성을 자연발생적과 연소기원으로 구분할 수 있으며, CPI의 값이 1에 가까울수록 인위적으로 배출된 n-alkanes가 지배적인 것으로 보고 되고 있다(Simoneit, 1989). 본 연구의 CPI의 평균은 2018년에 1.24, 2019년에 1.88이었다. CPI가 1보다 크고, Cmax가 C29인 것은 식물 기원의 n-alkanes가 우세한 것을 나타내므로(Kotianová et al., 2008), 본 연구의 2018년과 2019년의 서해상에서 n-alkanes는 식물기원으로 판단된다.
서해상의 유기성분 평균을 2017년 4~6월의 안면도에서 측정한 유기성분 결과와 비교하였다(Fig. 3). 총 유기성분의 농도는 비슷한 수준이지만 그룹별 유기성분의 분율은 다르게 나타났다. 서해상에서 Sugars는 mannosan과 levoglucosan 두 종을 분석하였으며, 2018년에 mannosan은 0.36 ± 0.52 ng m-3, levoglucosan은 11.67 ± 13.46 ng m-3, 2019년에 mannosan은 0.32 ± 0.52 ng m-3, levoglucosan은 6.66 ± 8.93 ng m-3이었다. Figure 3에 sugars 성분 중 levoglucosan의 농도를 비교하였다. 안면도에서는 바이오매스 연소의 지표인 sugars 성분 중 levoglucosan의 분율이 전체 유기성분의 15%를 차지하였는데, 이는 서해상에서의 levoglucosan의 비율(2018년 5%, 2019년 4%)보다 높았다. 반면, n-alkanoic acids는 안면도에서 18%의 비율로, 서해상의 27%보다 적은 분율을 차지하였다(Fig. 3b). 안면도에서는 바이오매스 연소와 같은 지역적인 활동의 특징이 나타난 반면, 서해상에서는 해양생물의 활동으로부터 기인한 n-alkanoic acids의 비중이 높게 나타났다.
3.3 YES-AQ 기간 중 공기괴 이동경로별 탄소성분 및 유기성분의 화학적 특성
2018년과 2019년 YES-AQ 기간 중 PM2.5 시료를 채취한 기간 중의 역궤적 자료에 대한 군집분석을 실시한 결과를 Fig. 5에 나타내었다. 2018년 군집분석 결과는 17일의 분석일 중 3일을 제외한 총 14일을 해양기원(Cluster 1)이 8일, 육지기원(Cluster 2)가 6일로 분류하였다. 2019년 23일은 3개의 군집으로 구분되어 산둥반도를 거쳐 유입한 궤적(Cluster 1)이 11일, 해양(Cluster 2)이 9일, 몽골에서부터 빠르게 유입한 궤적(Cluster 3)을 3일로 구분하였다. 주요 탄소성분과 유기성분의 구성 비율을 군집별로 분석하였다(Fig. 5). Figure 5에서 보듯이 해양에서 기원한 공기괴(2018년 Cluster 1, 2019년 Cluster 2)의 WISOC 비율이 육지에서 기원한 공기괴(2018년 Cluster 2, 2019년 Cluster 1과 Cluster 3)의 WISOC 비율보다 7~35% 작았다. 또한, 육지와 해양에서 유입된 공기괴를 비교하면 WSOC 중 친수성 성분인 non-HULIS-C의 비율이 해양에서 유입된 공기괴에서 11~27% 증가하는 특징을 보였다. 이는 해양으로부터 기원한 탄소에어로졸에는 수분함량이 높을 수 있음을 의미한다. 특히 몽골과 러시아에서부터 빠르게 서해로 유입된 공기괴(2019년 Cluster 3)는 WISOC의 비율이 크게 증가했으며, 유기성분에서는 DCAs는 15% 감소하고, Sugars와 PAHs, n-alkanes이 다른 공기괴의 유기성분 비율보다 증가한 특징을 보여준다. 이를 통해 몽골과 같은 대기오염이 심한 육지로부터 유입되는 공기괴는 바이오매스 연소와 같은 일차 배출의 영향이 큰 탄소에어로졸이 서해상의 대기질에 영향을 미칠 수 있음을 확인하였다.
3.4 YES-AQ 기간 중 고농도 사례별 탄소성분 및 유기성분의 화학적 특성
본 연구에서는 우리나라 일평균 PM2.5 대기환경기준인 35 μg m-3을 초과하는 사례를 고농도 사례로 구분하였다(Fig. 6). 사용한 PM2.5 자료는 YES-AQ 기간 동안 기상 1호에서의 자료이며, 2018년에는 국립기상과학원에서 저용량 공기채취기를 이용하여 포집한 PM2.5의 질량농도를, 2019년에는 국립환경과학원에서 Beta Attenuation Mornitors (BAMs)를 이용하여 측정한 PM2.5 농도를 활용하였다. 황사 발생시 입자가 약 2.0~10 μm 크기의 조대입자의 조성비가 증가하고, 연무 발생시 0.6~1.0 μm 크기의 입자 농도가 증가하는 것을 고려하여 고농도 사례들을 구분하였다. 2019년 YES-AQ 기간에는 PM2.5 및 PM10과 동시에 pm1.0의 농도자료가 광학 입자 계수기(Optical Particle Counter, OPC)를 통해 생산되어 황사 및 연무사례를 다음과 같이 구분하였다. PM10-PM2.5가 50 μg m-3 이상인 경우 황사 사례, pm1.0이 20 μg m-3 이상인 경우 연무 사례로 구분하였다(Cho et al., 2013; Kim et al., 2014). 2018년에는 저용량 공기채취기를 이용해 측정한 PM2.5와 PM10 질량 자료만 사용 가능하였기 때문에, 황사와 연무사례를 PM2.5/PM10 기준으로 구분하였다. PM2.5/PM10의 비율이 1/3 이하는 황사 사례, PM2.5/PM10의 비율이 1/2 이상인 경우는 연무 사례로 구분하였다(Ko et al., 2016). 2018년에는 고농도의 PM2.5가 4월 25일 한 차례(사례 a) 나타났고, 이 때, 탄소성분 및 총유기성분도 증가한 것을 확인하였다(Fig. 6a). 이 때의 대기오염상태는 앞의 기준에 따르면 연무상태로 구분되었다. 2019년에는 4월 23일(사례 b), 5월 1~2일(사례 c), 3일(사례 d), 4일(사례 e), 5일(사례 f), 16일(사례 g), 23일(사례 h), 총 7차례의 고농도 사례가 나타났다(Fig. 6b). 2019년 사례 b, g는 연무 사례, 사례 c는 황사사례, 사례 d, e, f, h는 황사와 연무가 혼재된 사례로 구분할 수 있다.
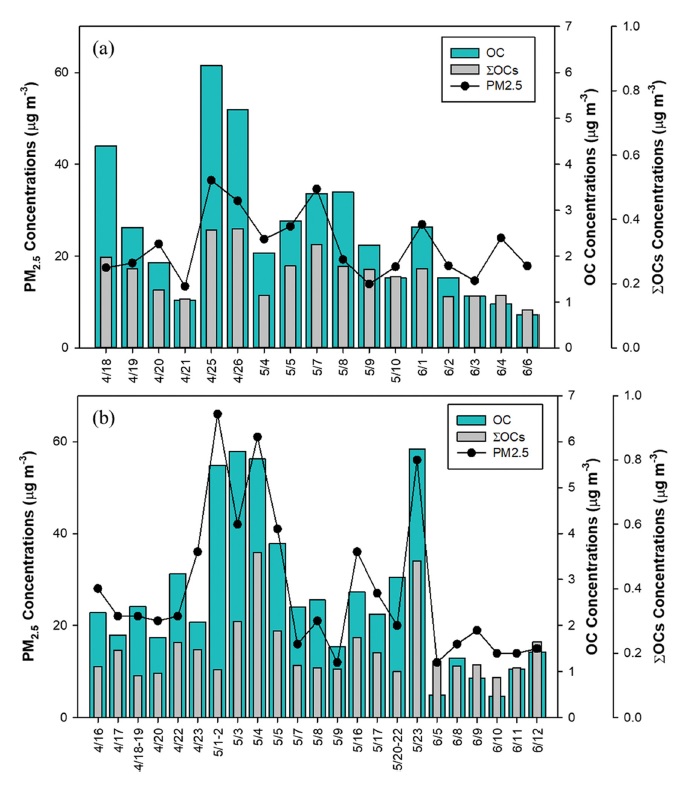
Daily mass concentrations of PM2.5 with OC and ∑OCs concentrations over the Yellow Sea during the YES-AQ Campaign in (a) 2018 and (b) 2019.
2018년과 2019년 서해상 OC의 고농도 사례별 탄소성분 분포와 유기성분을 Fig. 7에 나타냈다. 고농도 사례 a에 발생한 연무로 인해 탄소성분이 고농도 사례 발생일을 제외한 날의 약 3배 증가하였으며, 친수성 성분인 WSOC 및 HULIS-C의 농도가 측정일들에 비해 약 3배 증가하였다. 사례 a의 유기성분 중 n-alkanes, n-alkanoic acids, DCAs가 고농도 사례를 제외한 측정일들의 비해 40 ng m-3 이상 증가하였다. 황사사례 c는 WISOC의 농도와 분율이 고농도가 나타나지 않은 날의 약 3배 이상으로 증가하였는데, 몽골 혹은 러시아에서 빠르게 유입된 공기괴의 궤적에 따라 황사 발생시 친유성의 탄화수소의 영향이 커졌을 것으로 예상된다. 사례 c에서 고농도가 나타난 탄소성분과는 다르게 총 유기성분의 농도는 증가하지 않았으나 DCAs 중 Malic acid가 감소하고, levoglucosan이 5배 증가하였다. 이는 사례 c에 증가한 WISOC는 levoglucosan의 기원인 바이오매스 연소의 영향, 그리고 감소한 WSOC의 비율은 DCAs 농도의 감소와 관련이 있을 것으로 파악하였다. 사례 d는 고농도 사례를 제외한 날에 비해 WSOC의 농도가 2배 이상 증가 하였다. 사례 d의 개별 유기성분의 농도는 고농도가 나타나지 않은 날에 비해 약 2배 증가하였으나, 성분들의 조성비율 변화는 없었다. 사례 e에는 탄소성분의 증가와 함께 총 유기성분도 평균의 약 3배 이상으로 증가한 것을 확인하였으며, 특히 HULIS-C의 농도가 약 4배 증가하였다. 이때, 유기성분들의 분포를 확인한 결과, DCAs와 저분자량의 n-alkanoic acids (C10:0~C20:0)의 기여가 컸다. 따라서, 사례 e에서 탄소성분과 유기성분의 농도 증가는 해양에서 기원한 미생물의 활동 및 대기 중 화학 반응 또는 산화에 의한 영향이 증가한 것으로 해석할 수 있다. 사례 f는 연무와 황사가 발생하였으며, 전체 탄소성분 농도가 고농도가 발생하지 않은 날에 비해 약 2배 증가하였지만, 조성비율에는 큰 차이를 보이지 않았다. 또한, 연무와 황사가 동시에 발생한 사례 h에는 탄소성분 내 WSOC와 HULIS-C의 분율이 90%까지 증가했고, 유기성분은 DCAs가 3배 증가한 것을 확인하였다. 고농도 사례 중 연무와 황사가 동시에 나타난 사례 d와 e, f, h에서 탄소 구성성분 중 에어로졸의 산화 혹은 이차 생성을 나타내는 WSOC와 HULIS-C가 증가하였으며, 유기성분 중 이차 생성의 지표인 DCAs의 농도가 증가한 특징을 확인하였다. 증가한 DCAs는 Succinic acid, Malic acid와 함께 여름철 광화학 반응을 통해 생성되는 Glutaric acid (Huang et al., 2005)가 증가한 영향이 큰 것을 확인하였다. 이는 서해상에서 연무와 황사가 동시에 발생한 대기오염상태는 에어로졸의 산화 혹은 이차생성에서 기인한 것으로 판단하였다.
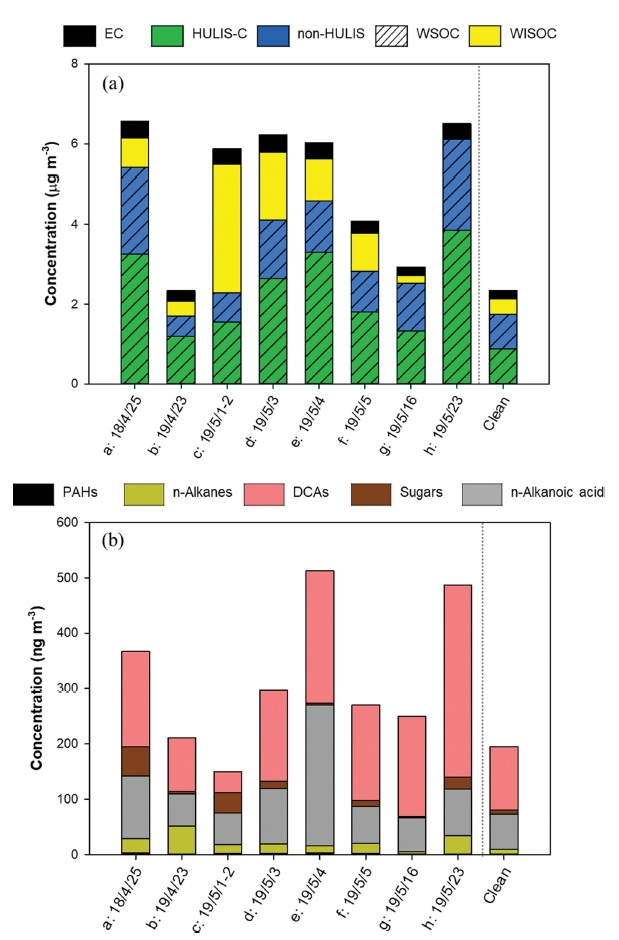
The concentration of (a) carbonaceous components and (b) organic compounds in high PM2.5 episodes with meteorological phenomena. “Clean” represents the average concentrations of compounds except the high PM2.5 episodes (a: Haze episode on 2018.4.25, 2018 Cluster 2; b: Haze episode on 2019.04.23, 2019 Cluster 2; c: Asian Dust episode on 2019.05.01~02, 2019 Cluster 3; d: Asian Dust and Haze episode on 2019.05.03, 2019 Cluster 1; e: Asian Dust and Haze episode on 2019.05.04, 2019 Cluster 1; f: Asian Dust and Haze episode on 2019.05.05, 2019 Cluster 1; g: Haze episode on 2019.05.16, 2019 Cluster 2; h: Asian Dust and Haze episode on 2019.05.23, 2019 Cluster 1).
4. 결 론
2018년과 2019년 YES-AQ 기간 동안 서해상에서 고용량공기채취기를 이용하여 PM2.5를 채취하여 PM2.5 내 탄소성분들(OC, EC, WSOC, HULIS-C)과 유기성분들(PAHs, n-Alkanes, n-Alkanoic acids, Sugars, DCAs)을 분석하였다. 서해상 PM2.5 내 탄소성분과 유기성분들의 농도는 Mann Whitney-U test 결과, 2018년과 2019년의 연간 차이가 유의미하지 않았다(p > 0.05). 서해상 PM2.5 내의 탄소성분 화학 조성은 WSOC가 약 87%를 차지하는 산화도가 높은 특징을 보였고, 유기성분은 이차생성 에어로졸의 지표로 활용되는 DCAs가 주를 이루어 탄소성분의 화학조성과 함께 서해상의 탄소에어로졸이 산화된 상태임을 확인하였다. 또한, 해양 식물플랑크톤의 영향을 받는 저분자량의 n-alkanoic acid의 농도가 안면도에 비해 높은 수준을 나타낸 반면, 바이오매스 연소와 같은 국지적인 배출을 나타내는 화학 성분의 농도는 안면도에 비해 서해상에서 낮게 나타났다.
탄소성분이 고농도로 발생한 사례를 연무와 황사와 같은 대기오염상태에 따라 구분하여 비교한 결과, 연무와 황사상태에 따라 WSOC와 HULIS-C의 농도 및 분율의 변화가 크게 나타나는 것을 확인했다. 황사 발생시에는 WISOC가 증가하였고, 바이오매스 연소 기원으로 알려진 Levoglucosan을 비롯한 연소 기원의 유기성분 농도가 증가하였다. 반면, 연무와 황사가 동시에 발생한 고농도 사례에서는 WSOC와 HULIS-C, DCAs가 증가하였는데, 이들은 공통적으로 에어로졸의 산화 혹은 이차생성을 나타내는 지표들이다. 본 연구를 통해 서해상의 PM2.5 내 탄소성분과 유기성분들은 이처럼 서해상 PM2.5 내 탄소성분과 유기성분들의 농도 및 화학조성은 대기오염상태 및 공기괴의 이동 경로에 따라 민감하게 변화함을 확인하였고, 이러한 화학조성 변화는 서해상 대기 에어로졸의 물리화학적 특성에 변화를 줄 수 있을 것으로 판단된다.
Acknowledgments
이 연구는 기상청 국립기상과학원 ‘황사·연무 감시 및 예보기술 개발(KMA2018-00521)’ 및 국립환경과학원 ‘입체관측을 통한 유기미세입자 및 주요 2차 입자상 물질의 국가 간 이동파악(NIER-RP2019-152)’의 지원을 받아 수행된 연구입니다.
References
-
Birch, M. E., and R. A. Cary, 1996: Elemental carbon-based method for monitoring occupational exposures to particulate diesel exhaust. Aerosol Sci. Tech., 25, 221-241.
[https://doi.org/10.1080/02786829608965393]

-
Cha, J. W., H.-J. Ko, B. Shin, H.-J. Lee, J. E. Kim, B. Ahn, and S.-B. Ryoo, 2016: Characteristics of aerosol mass concentration and chemical composition of the Yellow and South Sea around the Korean Peninsula using a Gisang 1 Research Vessel. Atmosphere, 26, 357-372. (in Korean with English abstract)
[https://doi.org/10.14191/Atmos.2016.26.3.357]

-
Cho, C., G. Park, and B. Kim, 2013: An effectiveness of simultaneous measurement of PM10, PM2.5, and pm1.0 concentrations in asian dust and haze monitoring. J. Environ. Sci. Int., 22, 651-666.
[https://doi.org/10.5322/JESI.2013.22.6.651]

-
Claeys, M., and Coauthors, 2010: Chemical characterisation of marine aerosol at Amsterdam Island during the austral summer of 2006-2007. J. Aerosol Sci., 41, 13-22.
[https://doi.org/10.1016/j.jaerosci.2009.08.003]

-
Decesari, S., and Coauthors, 2011: Primary and secondary marine organic aerosols over the North Atlantic Ocean during the MAP experiment. J. Geophys. Res. Atmos., 116.
[https://doi.org/10.1029/2011JD016204]

- Godec, R. G., P. P. Kosenka, B. D. Smith, R. S. Hutte, J. V. Webb, and R. L. Sauer, 1991: Total organic carbon analyzer. SAE Transactions, 100, 1248-1259.
-
Han, Y. M., Z. W. Han, J. J. Cao, J. C. Chow, J. G. Watson, Z. S. An, S. X. Liu, and R. J. Zhang, 2008: Distribution and origin of carbonaceous aerosol over a rural high-mountain lake area, Northern China and its transport significance. Atmos. Environ., 42, 2405-2414.
[https://doi.org/10.1016/j.atmosenv.2007.12.020]

-
Hatakeyama, S., M. Ohno, J.-H. Weng, H. Takagi, and H. Akimoto, 1987: Mechanism for the formation of gaseous and particulate products from ozone-cycloalkene reactions in air. Environ. Sci. Technol., 21, 52-57.
[https://doi.org/10.1021/es00155a005]

-
Hoffer, A., G. Kiss, M. Blazso, and A. Gelencsér, 2004: Chemical characterization of humic‐like substances (HULIS) formed from a lignin-type precursor in model cloud water. Geophys. Res. Lett., 31, L06115.
[https://doi.org/10.1029/2003GL018962]

-
Huang, X.-F., M. Hu, L.-Y. He, and X.-Y. Tang, 2005: Chemical characterization of water-soluble organic acids in PM2.5 in Beijing, China. Atmos. Environ., 39, 2819-2827.
[https://doi.org/10.1016/j.atmosenv.2004.08.038]

- IPCC, 2013: Climate change 2013: the physical science basis. Working Group I contribution to the Fifth assessment report of the Intergovernmental Panel on Climate Change. T. F. Stocker et al. Eds., Cambridge University Press, 1535 pp.
-
Jung, C. H., J. Y. Lee, J. Um, S. S. Lee, and Y. P. Kim, 2018: Chemical composition based aerosol optical properties according to size distribution and mixture types during smog and Asian dust events in Seoul, Korea. Asia-Pac. J. Atmos. Sci., 54, 19-32.
[https://doi.org/10.1007/s13143-017-0053-0]

-
Kanakidou, M., and Coauthors, 2005: Organic aerosol and global climate modelling: a review. Atmos. Chem. Phys., 5, 1053-1123.
[https://doi.org/10.5194/acp-5-1053-2005]

-
Kawamura, K., and F. Sakaguchi, 1999: Molecular distributions of water soluble dicarboxylic acids in marine aerosols over the Pacific Ocean including tropics. J. Geophys. Res. Atmos., 104, 3501-3509.
[https://doi.org/10.1029/1998JD100041]

-
Kawamura, K., R. Seméré, Y. Imai, Y. Fujii, and M. Hayashi, 1996: Water soluble dicarboxylic acids and related compounds in Antarctic aerosols. J. Geophys. Res. Atmos., 101, 18721-18728.
[https://doi.org/10.1029/96JD01541]

-
Kawamura, K., Y. Ishimura, and K. Yamazaki, 2003: Four years' observations of terrestrial lipid class compounds in marine aerosols from the western North Pacific. Global Biogeochem. Cy., 17, 3-1-3-19.
[https://doi.org/10.1029/2001GB001810]

-
Kim, K.-J., S.-H. Lee, D.-R. Hyeon, H.-J. Ko, W.-H. Kim, and C.-H. Kang, 2014: Composition comparison of PM10 and PM2.5 fine particulate matter for Asian dust and haze events of 2010-2011 at Gosan site in Jeju Island. Anal. Sci. Technol., 27, 1-10. (in Korean with English abstract)
[https://doi.org/10.5806/AST.2014.27.1.1]

-
Ko, H.-J., J.-M. Song, J. W. Cha, J. Kim, S.-B. Ryoo, and C.-H. Kang, 2016: Chemical composition characteristics of atmospheric aerosols in relation to haze, Asian dust and mixed haze-Asian dust episodes at Gosan site in 2013. J. Korean Soc. Atmos. Environ., 32, 289-304. (in Korean with English abstract)
[https://doi.org/10.5572/KOSAE.2016.32.3.289]

-
Kotianová, P., H. Puxbaum, H. Bauer, A. Caseiro, I. L. Marr, and G. Čík, 2008: Temporal patterns of n-alkanes at traffic exposed and suburban sites in Vienna. Atmos. Environ., 42, 2993-3005.
[https://doi.org/10.1016/j.atmosenv.2007.12.048]

-
Lee, J. H., Y. P. Kim, K.-C. Moon, H.-K. Kim, and C. B. Lee, 2001: Fine particle measurements at two background sites in Korea between 1996 and 1997. Atmos. Environ., 35, 635-643.
[https://doi.org/10.1016/S1352-2310(00)00378-2]

-
Lin, P., X.-F. Huang, L.-Y. He, and J. Z. Yu, 2010: Abundance and size distribution of HULIS in ambient aerosols at a rural site in South China. J. Aerosol Sci., 41, 74-87.
[https://doi.org/10.1016/j.jaerosci.2009.09.001]

-
Lukács, H., and Coauthors, 2007: Seasonal trends and possible sources of brown carbon based on 2‐year aerosol measurements at six sites in Europe. J. Geophys. Res. Atmos., 112, D23S18.
[https://doi.org/10.1029/2006JD008151]

-
Mayol-Bracero, O. L., P. Guyon, B. Graham, G. Roberts, M. O. Andreae, S. Decesari, M. C. Facchini, S. Fuzzi, and P. Artaxo, 2002: Water‐soluble organic compounds in biomass burning aerosols over Amazonia 2. Apportionment of the chemical composition and importance of the polyacidic fraction. J. Geophys. Res. Atmos., 107, LBA59-1-LBA59-15.
[https://doi.org/10.1029/2001JD000522]

- Mazurek, M. A., and B. R. T. Simoneit, 1984: Characterization of biogenic and petroleum-derived organic matter in aerosols over remote, rural and urban areas. Identif. Anal. Org. Pollut. Air, 353-370.
-
Miyazaki, Y., Y. Kondo, N. Takegawa, Y. Komazaki, M. Fukuda, K. Kawamura, M. Mochida, K. Okuzawa, and R. Weber, 2006: Time‐resolved measurements of water‐soluble organic carbon in Tokyo. J. Geophys. Res. Atmos., 111, D23206.
[https://doi.org/10.1029/2006JD007125]

-
Paglione, M., and Coauthors, 2014: Identification of humic-like substances (HULIS) in oxygenated organic aerosols using NMR and AMS factor analyses and liquid chromatographic techniques. Atmos. Chem. Phys., 14, 25-45.
[https://doi.org/10.5194/acp-14-25-2014]

-
Park, M., and Coauthors, 2021: Characterization of submicron aerosols over the Yellow Sea measured onboard the Gisang 1 research vessel in the spring of 2018 and 2019. Environ. Pollut., 284, 117180.
[https://doi.org/10.1016/j.envpol.2021.117180]

-
Putaud, J.-P., and Coauthors, 2010: A European aerosol phenomenology – 3: Physical and chemical characteristics of particulate matter from 60 rural, urban, and kerbside sites across Europe. Atmos. Environ., 44, 1308-1320.
[https://doi.org/10.1016/j.atmosenv.2009.12.011]

-
Rogge, W. F., M. A. Mazurek, L. M. Hildemann, G. R. Cass, and B. R. T. Simoneit, 1993: Quantification of urban organic aerosols at a molecular level: identification, abundance and seasonal variation. Atmos. Environ. Part A. General Topics, 27, 1309-1330.
[https://doi.org/10.1016/0960-1686(93)90257-Y]

-
Samburova, V., S. Szidat, C. Hueglin, R. Fisseha, U. Baltensperger, R. Zenobi, and M. Kalberer, 2005: Seasonal variation of high‐molecular‐weight compounds in the water‐soluble fraction of organic urban aerosols. J. Geophys. Res. Atmos., 110, D23210.
[https://doi.org/10.1029/2005JD005910]

-
Schauer, J. J., W. F. Rogge, L. M. Hildemann, M. A. Mazurek, G. R. Cass, and B. R. T. Simoneit, 1996: Source apportionment of airborne particulate matter using organic compounds as tracers. Atmos. Environ., 30, 3837-3855.
[https://doi.org/10.1016/1352-2310(96)00085-4]

-
Shilling, J. E., S. M. King, M. Mochida, D. R. Worsnop, and S. T. Martin, 2007: Mass spectral evidence that small changes in composition caused by oxidative aging processes alter aerosol CCN properties. J. Phys. Chem. A, 111, 3358-3368.
[https://doi.org/10.1021/jp068822r]

-
Simoneit, B. R. T., 1989: Organic matter of the troposphere — V: application of molecular marker analysis to biogenic emissions into the troposphere for source reconciliations. J. Atmos. Chem., 8, 251-275.
[https://doi.org/10.1007/BF00051497]

-
Simoneit, B. R. T., and M. A. Mazurek, 1982: Organic matter of the troposphere—II. Natural background of biogenic lipid matter in aerosols over the rural western United States. Atmos. Environ. (1967), 16, 2139-2159.
[https://doi.org/10.1016/0004-6981(82)90284-0]

-
Simoneit, B. R. T., G. Sheng, X. Chen, J. Fu, J. Zhang, and Y. Xu, 1991: Molecular marker study of extractable organic matter in aerosols from urban areas of China. Atmos. Environ. Part A. General Topics, 25, 2111-2129.
[https://doi.org/10.1016/0960-1686(91)90088-O]

-
Xiao, H.-Y., and C.-Q. Liu, 2004: Chemical characteristics of water-soluble components in TSP over Guiyang, SW China, 2003. Atmos. Environ., 38, 6297-6306.
[https://doi.org/10.1016/j.atmosenv.2004.08.033]

-
Yu, J. Z., H. Yang, H. Zhang, and A. K. H. Lau, 2004: Size distributions of water-soluble organic carbon in ambient aerosols and its size-resolved thermal characteristics. Atmos. Environ., 38, 1061-1071.
[https://doi.org/10.1016/j.atmosenv.2003.10.049]

-
Wang, H., K. Kawamura, and K. Yamazaki, 2006: Water-soluble dicarboxylic acids, ketoacids and dicarbonyls in the atmospheric aerosols over the Southern Ocean and western Pacific Ocean. J. Atmos. Chem., 53, 43-61.
[https://doi.org/ 10.1007/s10874-006-1479-4]